| 2023 ESMO主题报告 | 蒋明教授专访:ENKTL患者的福音,放疗联合免疫治疗 | |||||
|
|||||
|
前言 2023年欧洲肿瘤内科学会(ESMO)年会已于10月24日在西班牙马德里顺利收官。本次披露的5项血液肿瘤领域重磅口头报告研究中,有3项来源于中国学者。在此,特邀四川大学华西医院蒋明教授分析解读,帮助我们梳理放疗联合特瑞普利单抗在I/II期结外NK/T细胞淋巴瘤的应用前景。同时也期待放疗联合特瑞普利单抗这一治疗方案在未来淋巴瘤治疗领域再创佳绩,给更多患者带来福音。 NK/T细胞淋巴瘤(NKTCL)中最常见的类型是结外NK/T细胞淋巴瘤,鼻型。通常发生于上呼吸道,包括鼻腔、鼻咽、副鼻窦、扁桃体、下咽和喉,也可以累及鼻外,皮肤、睾丸和胃肠道是最常见的鼻外受累部位[1]。此型淋巴瘤在亚洲较欧美常见,是中国最常见的外周 T 细胞淋巴瘤类型,占所有外周T细胞淋巴瘤的 40%~50%[2]。其发病与EB病毒的感染相关,且整体异质性非常高。治疗方法包括局部放疗、化疗、造血干细胞移植等。早期,以蒽环类为基础的化疗方案在ENKTL中治疗的临床结局较差。目前,I/II期结外NK/T细胞淋巴瘤(ENKTL)的标准治疗是基于L-门冬酰胺酶或培门冬酶的多药化疗联合放疗,化疗的有效率通常在70-80%。然而,对化疗方案敏感性不佳的患者总生存期(OS)显著降低。与此同时,早期ENKTL的一线治疗手段是局部放疗,5年生存率约70%[3]。此前,PD-1抑制剂在ENKTL中的疗效已得到证实,且放疗可增强PD-1抑制剂的抗肿瘤效果[4]。由此,蒋明教授及其团队决定从放疗联合免疫治疗的角度出发,探索放疗联合特瑞普利单抗对于前期治疗疗效不佳的I/II期ENKTL中的疗效与安全性。
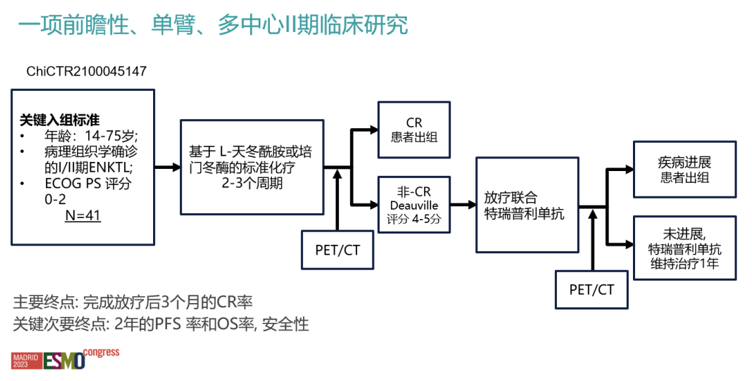
特瑞普利单抗联合放疗对于之前标准化疗反应不佳的ENKTL患者安全有效 研究目的:该研究是一项前瞻性、单臂、多中心、Ⅱ期临床研究,旨在探索特瑞普利单抗联合化疗治疗化疗反应不佳的Ⅰ/Ⅱ期ENKTL患者的安全性和有效性。研究对象:该研究计划纳入41例患者,入组标准为:年龄14-75岁,病理和组织学证实为Ⅰ/Ⅱ期ENKTL且美国东部肿瘤协作组体能状态评分0-2分。接受过2-3个周期包含L-门冬酰胺酶或培门冬酶的多药化疗方案后PET/CT疗效评分为4-5分的I/II期ENKTL患者。 研究方法:研究招募患者在标准放疗(95% PTV 56Gy/28f,d1-d5/w)的基础上联合特瑞普利单抗(240mg,Q3w)进行治疗,在前期化疗有效的患者中放疗后再进行2周期多药化疗,其余患者放疗之后接受特瑞普利单抗治疗总共1年或直到疾病进展或出现无法忍受的毒性。 研究终点:其主要研究终点为放疗后3个月的完全缓解(CR)率,关键次要研究终点包括2年无进展生存(PFS)率和2年OS率以及安全性。
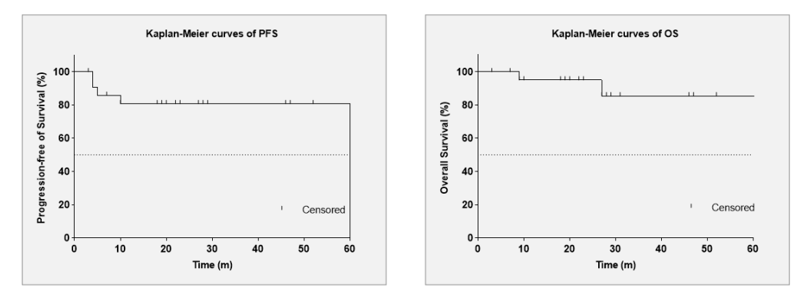
图1. 研究设计 从2019年2月至今,本次分析纳入了至少经过一次疗效评估的22名患者。所有患者病灶原发于上呼吸消化道,中位年龄为44岁(范围26-64岁),其中14名为男性。17名患者(77.3%)的Lugano分期为I期,5名患者(22.7%)为II期;81%的患者局部肿瘤外侵(PTI)。接受前2-3个周期化疗后,8/22名患者(36.4%)疗效评价为部分缓解(PR),8/22名患者(36.4%)疗效评价为疾病稳定(SD),6/22名患者(27.2%)疗效评价为疾病进展(PD)。 截至目前,中位随访时间为23个月(范围3个月-78个月),放疗后3个月PET/CT评估的客观缓解率(ORR)为90.9%, CR 率77.3% ,PR率 (13.6%), PD率 (9.1%),2年无进展生存(PFS)率和OS率分别为81.6%和95%,2例PD患者已死亡,OS分别为9个月和26个月。放疗期间和放疗后的主要不良事件包括血液学异常、口腔黏膜炎和甲状腺功能减退症。未发生3级或更高毒性反应。
图2. 特瑞普利单抗联合化疗的PFS和OS率 ENKTL的免疫治疗还在探索阶段,而这项研究树立起了ENKTL治疗的新的方向,即放疗联合免疫治疗。放疗可通过多种机制上调PD-L1的表达:①诱导癌细胞的DNA损伤。②促进肿瘤微环境中促炎因子释放,促使PD-L1表达增多,增强抗PD-L1效果[5]。③高剂量电离辐射还可直接改变肿瘤微环境,促进肿瘤微环境中PD-L1表达上调。但具体机制仍需进一步探索。 蒋明教授提及,该方案不仅为ENKTL患者安全有效的治疗提供新选择。从药物经济学方面来讲看,特瑞普利单抗联合放疗的治疗方案也将减轻以往我国ENKTL患者需用进口高价药物及多种药物共同治疗的沉重经济负担,实现高性价比、高获益、高安全性的全面兼顾,为患者带来更为显著的临床获益。 最后,蒋明教授总结道:“总之,该项研究证明了特瑞普利单抗联合放疗可有效治疗化疗不佳的I/II期ENKTL患者,提高临床疗效的同时又可以避免不必要的用药,并且安全性良好,未观察到其他毒性,值得进一步探索。”
参考文献: [1] Bennani NN, Tun AM, Carson KR, et al. Characteristics and Outcome of Extranod al NK/T-cell Lymphoma in North America: A Retrospective Multi-Institutional Expe rience.2022;22(4):e250-e260. [2] Haverkos BM, Pan Z, Gru AA, et al. Extranodal NK/T Cell Lymphoma, Nasal Ty pe (ENKTL-NT): An Update on Epidemiology, Clinical Presentation, and Natural H istory in North American and European Cases. Curr Hematol Malig Rep. 2016. 11(6): 514-527. [3] Zheng X, He X, Yang Y, et al. Association of improved overall survival with decr eased distant metastasis following asparaginase-based chemotherapy and radiotherapy for intermediate- and high-risk early-stage extranodal nasal-type NK/T-cell lympho ma: a CLCG study. ESMO Open. 2021.6(4):100206. [4] SATO H, NIIMI A, YASUHARA T, et al. DNA doublestrand break repair pathway regulates PD-L1 expression in cancer cells. Nat Commun, 2017,8(1):1751 [5] PITTET C L, NEWCOMBE J, PRAT A, et al. Human brain endothelial cells endeavor to immunoregulate CD8 T cells via PD-1 ligand expression in multiple sclerosis. J Neuroinflammation, 2011,8:155. |
|||||