| 2023 ESMO|吴炅教授:从NATALEE研究治疗方案,看OFS在绝经前HR+早期乳腺癌中的临床价值 | |||||
|
|||||
|
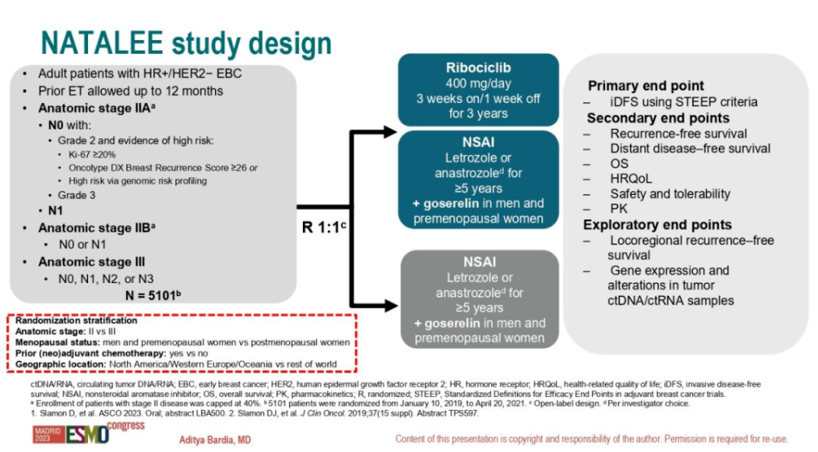
乳腺癌已成为中国乃至全球女性常见的恶性肿瘤之一,激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)是最常见的乳腺癌亚型,约占所有乳腺癌的70%[1]。早期乳腺癌的治疗目标是治愈,包括降低近期及远期复发风险。辅助内分泌治疗(ET)是HR+/HER2-早期乳腺癌的标准方案,尤其是对于绝经前中、高危患者。多项临床研究已经证实OFS单药或联合方案可显著降低这类患者的复发和死亡风险,已成为国内外各大指南推荐的首选方案。 CDK4/6抑制剂联合ET为晚期HR+/HER2-乳腺癌患者带来显著获益,其疗效鼓舞研究者不断探索该类药物在早期辅助治疗中的应用,如PALLAS、PENELOPE-B和MonarchE研究已发布相关结果。本次ESMO大会公布了NATALEE研究(摘要号:LBA23)关键亚组数据,结果显示CDK4/6抑制剂联合NSAI及OFS(绝经前女性及男性患者)相比对照组的iDFS获益更多,且与疾病分期,淋巴结累及状态,绝经状态,年龄和Ki-67评分无关。值得注意的是对于所有绝经前女性患者研究方案要求联合OFS药物戈舍瑞林植入剂治疗,这是基于临床实际治疗需求的合理选择,肯定了OFS在绝经前HR+早期乳腺癌中的重要地位。值此契机,特邀复旦大学附属肿瘤医院吴炅教授从临床实践角度解读NATALEE研究,以启迪临床。 NATALEE研究简介及主要结果回顾 NATALEE是一项全球、多中心、开放标签、随机的III期研究,旨在评估瑞波西利联合ET相较于ET在HR+/HER2-早期乳腺癌患者的疗效和安全性。共纳入5101例具有复发风险的II期或III期HR+/HER2-早期乳腺癌患者,按照1:1比例随机分配至瑞波西利(400mg/d,给药3周+停药1周,持续3年)联合ET组(来曲唑2.5mg/天或阿那曲唑1mg/天,持续≥5年,男性和绝经前女性接受戈舍瑞林植入剂治疗)或单独ET组。主要终点是根据STEEP标准评估的无浸润性疾病生存(iDFS);次要终点包括无复发生存期(RFS)、无远处转移生存期(DDFS)、总生存期(OS)、健康相关生命质量(HRQoL)、安全性和耐受性,以及药代动力学。探索性终点为无局部区域复发生存期(LRFS)和肿瘤ctDNA/ctRNA样本中的基因表达和改变情况。
图1. NATALEE研究设计 2023年ASCO大会最先公布的研究结果显示,瑞波西利联合NSAI及OFS组与对照组相比,ITT人群iDFS具有统计学上的显著获益,3年iDFS率分别为90.4%和87.1%,绝对值获益3.3%[2]。本届ESMO大会进一步报告了NATALEE研究预设关键亚组的iDFS[3],结果显示,瑞波西利联合NSAI及OFS组与对照组相比:
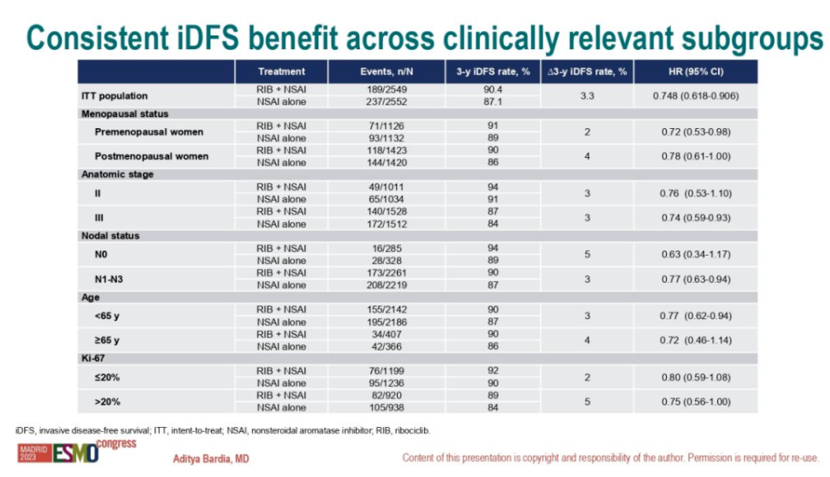
· 在Ki-67≤20%的患者中,3年iDFS率分别为92%和90%;在Ki-67>20%的患者中,3年iDFS率分别为89%和84%。 整体而言,各关键亚组的iDFS获益与ITT人群一致,与疾病分期、淋巴结累及、绝经状态、年龄和Ki-67水平无关。该结果进一步支持瑞波西利联合NSAI及OFS可作为II期或III期HR+/HER2-早期乳腺癌复发风险患者(包括淋巴结阴性疾病患者)的治疗选择。
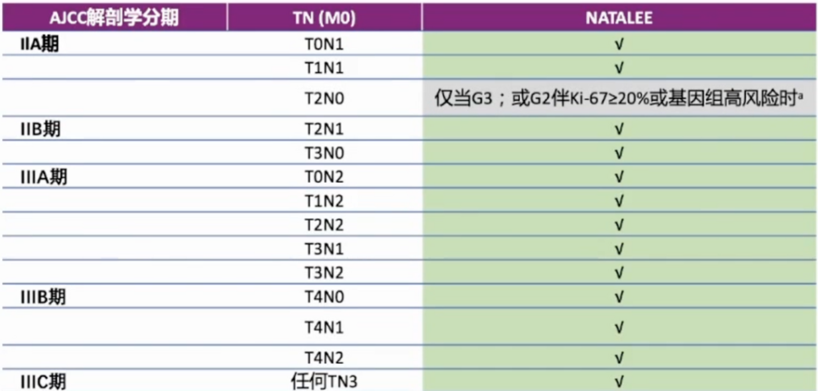
图2. NATALEE研究亚组iDFS获益 NATALEE研究带来的临床启示: OFS在绝经前中高危HR+早期乳腺癌的治疗中不可或缺 从入组人群看,NATALEE研究纳入的患者范围更广,包括解剖学IIA期:N0(Grade3或Grade 2伴高危因素:Ki67≥20%或Oncotype DX乳腺癌复发风险评分≥26分或其他高风险基因特征)或N1;解剖学IIB期:N0或N1;解剖学III期:N0,N1,N2或N3。而另一项早期研究MonarchE排除了II期和III期N0的患者,仅包括淋巴结阳性(其中N1还需要其他高风险临床特征)人群[4],符合条件的患者只占临床实践中的小部分患者群体。鉴于此,NATALEE研究一定程度上满足了更广泛患者的治疗需求,包括那些具有额外临床或基因高风险特征的N0患者。
图3. NATALEE研究入组人群 此外该研究纳入了约44%的绝经前患者,这类患者的乳腺癌具有组织学分级高、Ki-67高表达、脉管浸润比例高等较强的侵袭性生物学行为[5],预后与绝经后患者相比有一定差异。近年来中国年轻乳腺癌发病率也呈逐年增高的趋势,复旦大学附属肿瘤医院登记的<40岁新诊断乳腺癌患者占比由1999年的11.4%上升至2017年的16.4%[6];另一项中国流行病学研究显示乳腺癌的中位诊断年龄为48~50岁,其中约60%的患者在诊断时为绝经前状态[7]。该类患者往往卵巢功能更为活跃,体内雌激素水平较高,与绝经后患者相比有更高的复发风险。而OFS类药物可降低患者体内雌激素水平至绝经后状态,进而降低远期复发风险,已成为绝经前HR+中、高危乳腺癌患者辅助内分泌治疗的基石。 l 2016年的美国临床肿瘤协会(ASCO)关于OFS的指南指出[11],临床分期为II期或III期应接受辅助化疗的患者,推荐接受含OFS的内分泌治疗;临床分期为I期或II考虑使用化疗的较高危患者,考虑含OFS的内分泌治疗。 l 2023年St. Gallen共识中[12],临床分期I-II期高风险乳腺癌患者(尤其需要化疗、年龄<40岁、高组织学分级或中基因组评分16-25)推荐含OFS的内分泌治疗。 因此,NATALEE研究要求所有绝经前患者均联合了OFS戈舍瑞林植入剂治疗,与国内外权威指南/共识关于绝经前中、高危HR+乳腺癌辅助内分泌治疗的推荐相一致。 本届ESMO大会发布的III期NATALEE研究关键亚组结果显示,瑞波西利联合NSAI及OFS方案为中、高危HR+早期乳腺癌患者的辅助治疗提供了一种新的选择。而细看研究方案发现与其他类似研究不同,NATALEE研究中所有绝经前女性或男性(仅占约0.4%)均需联合OFS戈舍瑞林植入剂治疗,这样的方案设定符合临床实际。因此随着HR+/HER2-早期乳腺癌辅助治疗方案的不断丰富,对于中、高危患者OFS的作用仍不可或缺。 参考文献: [1]《CDK4/6抑制剂治疗激素受体阳性人表皮生长因子受体2阴性晚期乳腺癌的临床应用共识》 [2]Bardia A, Hortobagyi G, Lipatov O, et al. lnvasive disease-free survival across keysubgroups from the Phase Ill NATALEEstudy of ribociclib + a nonsteroidalaromatase inhibitor in patients withHR+/HER2- early breast cancer. 2023 ESMO LBA23. [3]Slamon D, Strovakovskiy D, Yardley DA, et al. Ribociclib and endocrine therapy as adjuvanttreatment in patients with HR+/HER2- earlybreast cancer: primary results from the Phase lll NATALEE trial. 2023 ASCO LBA500. [4]Paluch-Shimon S, Neven P, Huober J, et al. Efficacy and safety results by menopausal status in monarchE: adjuvant abemaciclib combined with endocrine therapy in patients with HR+, HER2-, node-positive, high-risk early breast cancer. Ther Adv Med Oncol. 2023 Feb 3;15:17588359231151840. [5]《中国年轻乳腺癌诊疗专家共识(2022)》 [6]Guo R, Si J, Xue J, et al. Changing patterns and survival improvements of young breast cancer in China and SEER database, 1999-2017. Chin J Cancer Res. 2019 Aug;31(4):653-662. [7]Yang Y, Liu J, Peng M, et al. Introduction of a multicenter online database for non-metastatic breast cancer in China. Sci China Life Sci. 2020 Sep;63(9):1417-1420. [8]Gnant M, Dueck AC, Frantal S, et al. Adjuvant Palbociclib for Early Breast Cancer: The PALLAS Trial Results (ABCSG-42/AFT-05/BIG-14-03). J Clin Oncol. 2022 Jan 20;40(3):282-293. [9]Loibl S, Marmé F, Martin M, et al. Palbociclib for Residual High-Risk Invasive HR-Positive and HER2-Negative Early Breast Cancer-The Penelope-B Trial. J Clin Oncol. 2021 May 10;39(14):1518-1530. [10]《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)》. [11]BURSTEIN H J, LACCHETTI C, ANDERSON H, et al. Adjuvant endocrine therapy for women with hormone receptorpositive breast cancer: American society of clinical oncology clinical practice guideline update on ovarian suppression. J Clin Oncol, 2016, 34(14): 1689-1701. [12]Curigliano G, Burstein HJ, Gnant M, et al. Understanding breast cancer complexity to improve patient outcomes: The St. Gallen International Consensus
|
|||||